Choroby rzadkie – częsty problem (cz. 1)

Zdjęcie autorstwa Sharon McCutcheon | Unsplash
Autorzy: Szczepan Jakubowski, Paweł Kawalec
Mimo, że poszczególne choroby rzadkie nie występują często w populacji to koszty ich farmakoterapii mogą stanowić spore wyzwanie dla wielu systemów ochrony zdrowia. Głównym powodem są wysokie koszty leków stosowanych w ich przypadku, czyli tzw. leków sierocych (ang. orphan drugs).
Według wytycznych Komisji Europejskiej każde schorzenie dotykające mniej niż pięć osób na 10 tyś. jest uznawane za chorobę rzadką (ang. rare disease). Cześć pacjentów cierpi na jeszcze mniej spotykane tzw. choroby ultrarzadkie (ang. ultrarare diseases). Te ostatnie występują w przypadku jednej (lub nawet mniej niż jednej) osoby na 100 tyś. Szacuje się, że około 5-8 tys. różnych rodzajów chorób rzadkich dotyka 6-8% populacji UE, co stanowi od 27 do nawet 36 mln chorych [1].
W chorobach rzadkich stosuje się leki nazywane sierocymi produktami leczniczymi. Słowo ,,sieroce” w tym przypadku oznacza potencjalny brak zainteresowania firm farmaceutycznych ich produkcją i badaniami nad ich nowymi wariantami. Z punktu widzenia biznesowego leki sieroce stanowią niezbyt atrakcyjny obszar działalności.
Co ciekawe, brakuje wspólnej i powszechnej definicji leków sierocych, co często bywa przyczyną rozbieżności między definicjami stosowanymi w różnych krajach [2]. Według Europejskiej Agencji Leków (EMA) sierocy produkt leczniczy (ang. orphan medicinal product, OMP) to taki, który służy diagnozowaniu, zapobieganiu lub leczeniu stanu chorobowego zagrażającego życiu lub chronicznie osłabiającego – gdy:
- wskazany stan chorobowy występuje u nie więcej niż 5 na 10 tyś. osób w Unii Europejskiej (w momencie składania wniosku o rejestrację);
- firmy farmaceutyczne nie podjęłyby się badań i rozwoju w tym obszarze bez ułatwień dotyczących rejestracji oraz refundacji leków sierocych;
- nie dopuszczono żadnej zadowalającej metody diagnozowania, zapobiegania lub leczenia danego stanu chorobowego lub też, jeżeli taka metoda istnieje, a produkt leczniczy przyniesie znaczące korzyści osobom dotkniętym tym stanem [3].

Światowy Dzień Chorób Rzadkich obchodzony jest ostatniego dnia lutego; w 2019 r. był to 28 lutego
Z powodu wysokich kosztów leków sierocych terapia nawet niewielkich grup pacjentów przekłada się na znaczne obciążenie finansowe dla budżetów płatników publicznych (np. Narodowego Funduszu Zdrowia). Jest to istotny aspekt właściwej alokacji finansów publicznych, stanowiący poważny problem dla zdrowia publicznego i procesu decyzyjnego na szczeblu krajowym. Fakt ten może znaleźć odzwierciedlenie w dużym zróżnicowaniu decyzji dotyczących refundacji sierocych produktów leczniczych w państwach członkowskich UE [2].
W niektórych krajach przyjęto rozwiązania prawne zachęcające do opracowywania nowych leków sierocych. Zapewniają one bodźce o charakterze finansowym, rozwojowym i regulacyjnym. Do najważniejszych rozwiązań można zaliczyć:
- przyspieszenie procedur i ich ułatwienie rejestracji nowego leku sierocego (mniej restrykcyjne wymogi odnośnie badań klinicznych),
- gwarancja wyłączności obrotu leku na rynku przez 10 lat,
- ułatwienia dotyczące warunków refundacji i uzgodnień odnośnie cen urzędowych leków sierocych (ang. Pricing and Reimbursement, P&R),
- zwolnienie z opłat podczas ubiegania się o decyzje refundacyjne,
- zniesienie obowiązku przeprowadzania analiz oceny technologii medycznych (HTA), przy ubieganiu się o refundację [4].
Podczas podejmowania decyzji o refundacji leków sierocych kluczową rolę odgrywa status leku przyznany przez EMA. Agencja ta może np. warunkowo zatwierdzić leki sieroce – wymagając od wnioskodawcy dostarczenia dalszych informacji klinicznych w późniejszym czasie. Problem w tym, że np. we Francji, Włoszech i Hiszpanii takie warunkowe zatwierdzenie znacznie zmniejszyło szanse na refundacje tych leków. Sugeruje to, że decydenci w pewnych krajach czekają na dodatkowe informacje dotyczące skuteczności lub bezpieczeństwa. W innych krajach, tymczasem, status warunkowy leku sierocego jest brany pod uwagę w znacznie mniejszym stopniu [2].
Kwestie finansowe są głównym powodem różnic pomiędzy politykami refundacyjnymi różnych państw. Wiele krajów stosuje dodatkowe mechanizmy umożliwiające dostęp do leków, w przypadku których istnieje niepewność (w momencie dopuszczania do obrotu). Niepewność taka może dotyczyć skuteczności klinicznej, opłacalności lub wpływu na budżet. Mechanizmy te powszechnie określa się mianem kontrolowanych umów wejścia (ang. managed entry agreements, MEA). Są to porozumienia pomiędzy płatnikami a producentami leków w celu podziału kosztów związanych z niepewnością. Celem MEA jest ułatwienie dostępu do nowych i drogich leków, w tym leków o statusie sierocym [2]. Jednak mimo ich coraz częstszego stosowania rosnące wydatki na leki sieroce wciąż stanowią duże wyzwanie dla finansowej stabilności europejskich systemów zdrowotnych [5].
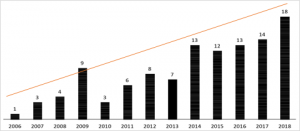
Wykres 1. Liczba sierocych produktów leczniczych w Europie (z oznaczeniem EMA) wg daty wydania pozwolenia na dopuszczenie do obrotu | opracowane własne na podstawie: [6]
Liczba zarejestrowanych leków sierocych w Unii Europejskiej stopniowo rośnie (Wykres 1.). Z jednej strony jest to zjawisko pozytywne dla pacjentów ze względu na możliwość leczenia. Z drugiej strony może stawiać decydentów odpowiedzialnych za politykę lekową państwa przed niełatwym zadaniem czy refundować drogi lek, a jeśli tak, to na jakim poziomie [6].
Kontakt do autorów: Szczepan Jakubowski, Paweł Kawalec
Blog Zdrowia Publicznego, red. M. Zabdyr-Jamróz, Instytut Zdrowia Publicznego UJ CM, Kraków: 10 maja 2019
Źródła:
- European Commission. Rare diseases. Policies, information and services. [dostęp 19 styczeń 2019].
- Malinowski KP, Kawalec P, Trabka W, Sowada C, Pilc A. Reimbursement of orphan drugs in Europe in relation to the type of authorization by the European Medicines Agency and the decision making based on Health Technology Assessment. Front Pharmacol. 2018 [dostęp 18 styczeń 2019]; 9.
- Orphan drugs and rare diseases at a glance. EMEA/290072/2007. W London; 2007 [dostęp 19 styczeń 2019]. s. 2.
- Macaulay R, et al. A comparison of P&R requirements for orphan drugs in 25 markets (poster) [w:] Barcelona: PAREXEL International; 2018 [dostęp 18 styczeń 2018].
- Szegedi M, Zelei T, Arickx F, Bucsics A, Cohn-Zanchetta E, Fürst J, i in. The European challenges of funding orphan medicinal products. Orphanet Journal of Rare Diseases. 6 listopad 2018;13(1):184.
- Lists of medicinal products for rare diseases in Europe [dostęp 21 styczeń 2019].
 FACEBOOK
FACEBOOK INSTAGRAM
INSTAGRAM X
X LINKEDIN
LINKEDIN YOUTUBE
YOUTUBE